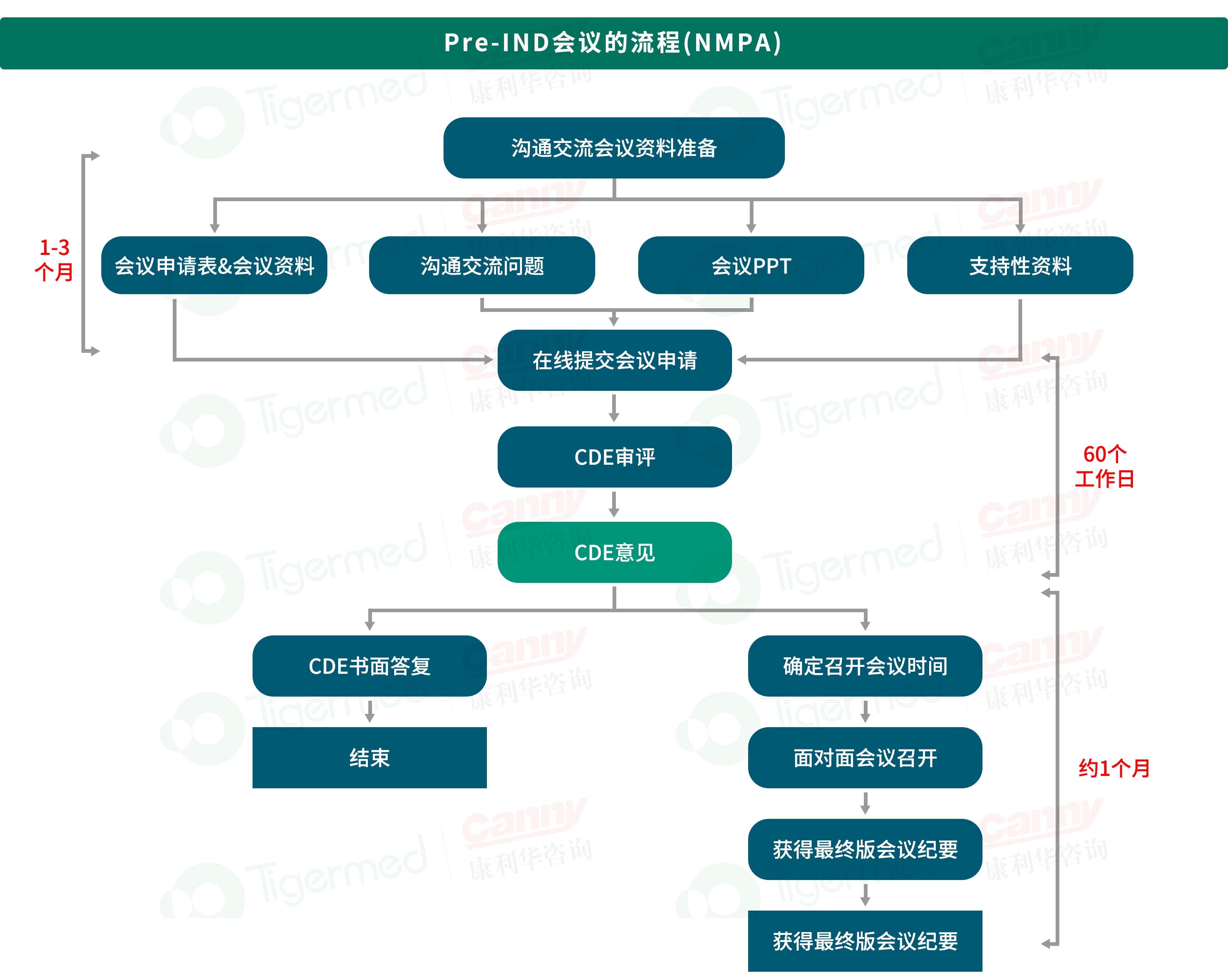
NMPA Pre-IND沟通交流
1.沟通交流会议申请表
2.沟通交流会议资料(含问题清单和申办方立场,对应FDA的briefing book);
3.会议PPT
4.支持性资料,包括但不限于以下资料:
临床研究方案
临床开发计划
IB 或者 m2.4 +m 2.5 (如有)
M2.3 ?风险管理计划(可选)
非临床研究报告/CSR(如有)
其他
时间:5-8个月,平行于IND资料准备进行。
您值得信赖的医药法规符合专业顾问
NMPA Pre-IND沟通交流
1.沟通交流会议申请表
2.沟通交流会议资料(含问题清单和申办方立场,对应FDA的briefing book);
3.会议PPT
4.支持性资料,包括但不限于以下资料:
临床研究方案
临床开发计划
IB 或者 m2.4 +m 2.5 (如有)
M2.3 ?风险管理计划(可选)
非临床研究报告/CSR(如有)
其他
时间:5-8个月,平行于IND资料准备进行。

您值得信赖的医药法规符合专业顾问
全国热线:
400-8770626
邮箱:
Canny@TigermedGrp.com
地址:
中国·北京市朝阳区朝阳门外大街20号联合大厦808室
邮编:
100022

