|
|
新药审评包括两个过程 |
1.新药临床试验申请(简称IND) |
|
|
2.新药上市申请(简称NDA) |
|
|
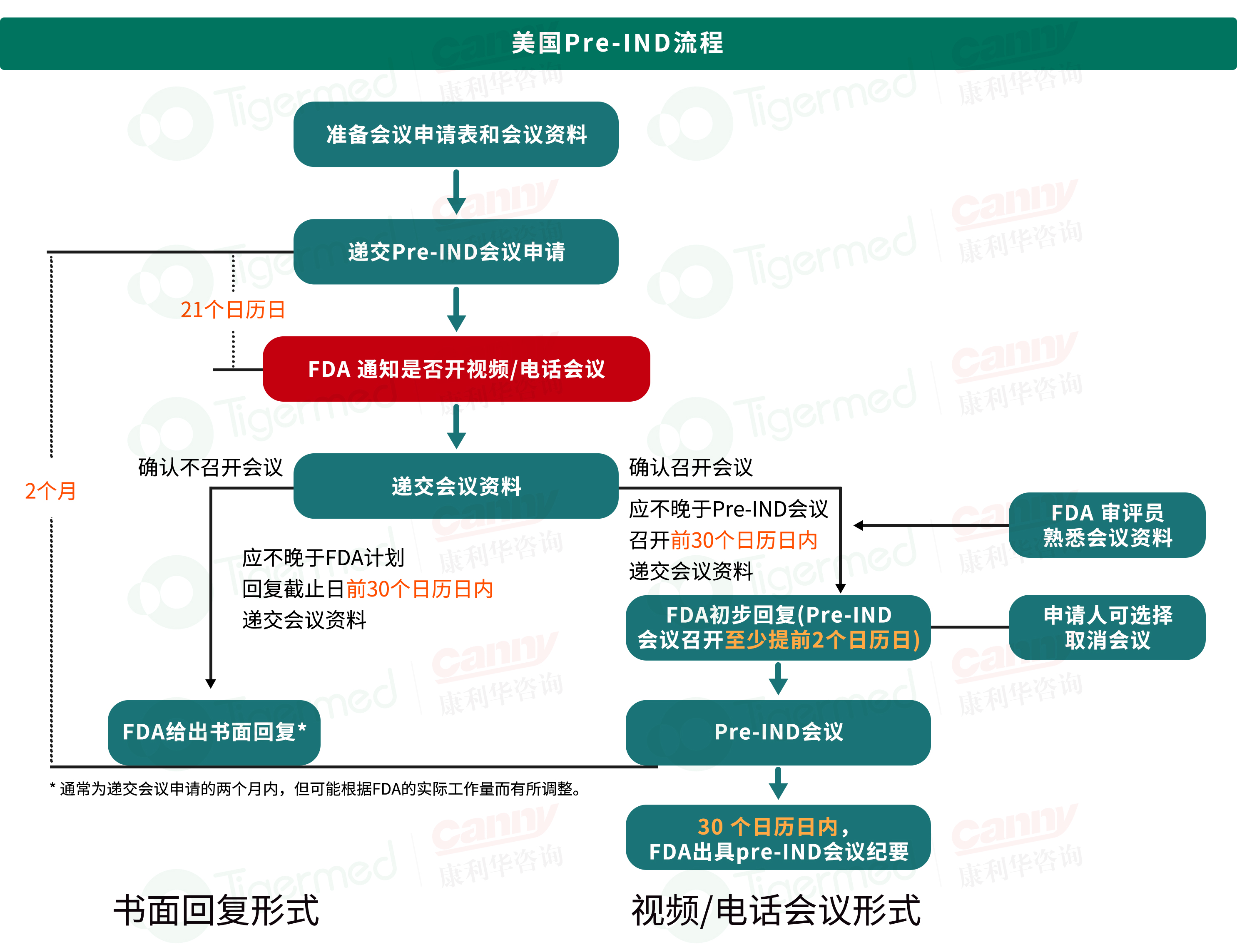
Pre-IND沟通交流 |
|
|
|
美国代理?临床方案审核/撰写 |
|
|
|
MW对FDA沟通交流会会议资料准备的支持(临床相关部分) |
|
|
|
会议申请资料的准备 |
|
|
|
会议在线递交及跟进 |
|
|
|
CDER/CBER沟通交流会议召开(包括远程会议和面对面会议) |
|