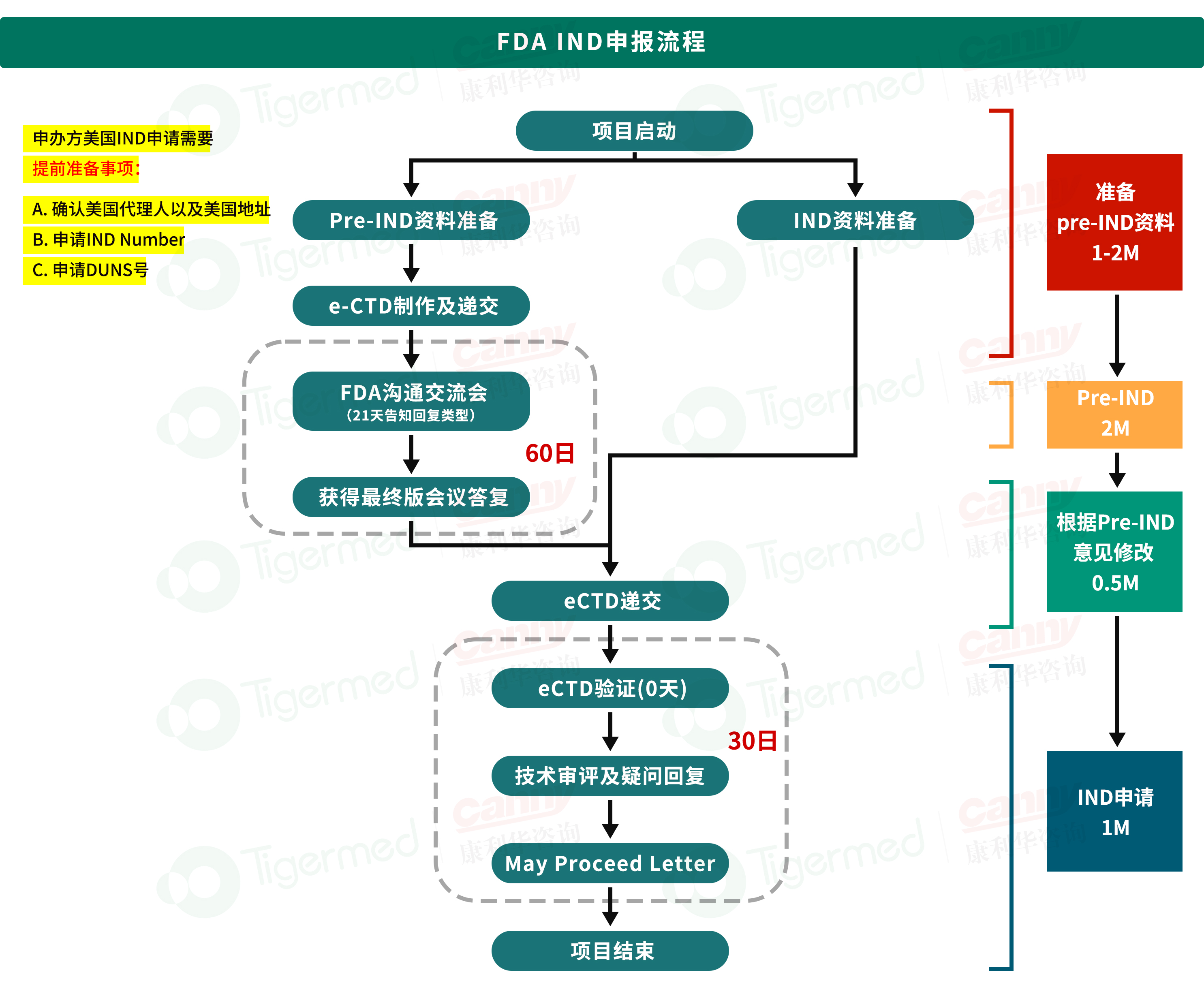
FDA IND阶段的资料要求
1.递交形式:从2018年5月5日起,强制要求eCTD
2.IND通常要求包含以下三方面的信息:
CMC资料
药理毒理资料
临床方案
|
FDA IND申请服务内容 |
|||||||
|
美国代理 |
临床试验方案撰写 |
临床开发计划撰写 |
临床研究总结报告撰写 |
临床综述撰写 |
说明函 |
3674表 |
环境评估分析 |
|
总体研究计划 |
研究药物包装标签 |
ICF样稿 |
PI CV、1572表 |
研究者手册 |
RCP |
申报资料准备 |
资料的递交及审评跟进 |